米国製薬業界週報に、弊社の取締役会長戸須インタビュー記事が掲載
米国製薬業界週報(2021年9月24日発行第870号)にて、弊社取締役会長戸須のインタビュー記事が掲載されました(記事名「脳疾患治療薬分野におけるインテルを目指す」)
血液脳関門突破の新規薬剤送達システムの開発が加速しており、弊社も医薬品のミセル化によるBBB突破技術で、CNS系疾患治療薬分野で様々な医薬品に、弊社のベストインクラスのDDSが入っている世界を目指しております。
記事(抜粋)
血液脳関門を突破し、医薬品を脳に送達
新規薬剤送達システムの開発が加速
脊椎動物の循環器系は、血液を送り出すポンプとしての心臓、送り出された血液を全身に運ぶ動脈、全身の血液を心臓に戻す静脈からなる血管系と、リンパ液が流れるリンパ管とリンパ節からなるリンパ系の2つで構成される。リンパ系は体内の老廃物を排出する働きを持つが、体の機能を制御し、あらゆる活動を司る脳には通っておらず、その代わりに血液脳関門(BBB)と呼ばれる特殊化された細胞の密着結合層が脳の血管と脳細胞間の物質の出入りを管理している。BBBは脳の最適環境の維持に不可欠である一方、一部の栄養素や脂溶性低分子を除き、高極性の化合物、ペプチド、核酸、抗体を含む多くの高分子化合物の血流を介した脳内移行を妨ぐことから、ときに諸刃の剣ともなる。脳腫瘍や神経変性疾患の治療薬開発においては、BBBを通過し、いかに薬剤を脳内に届けるかが大きな課題となっている。
既存のアプローチと課題
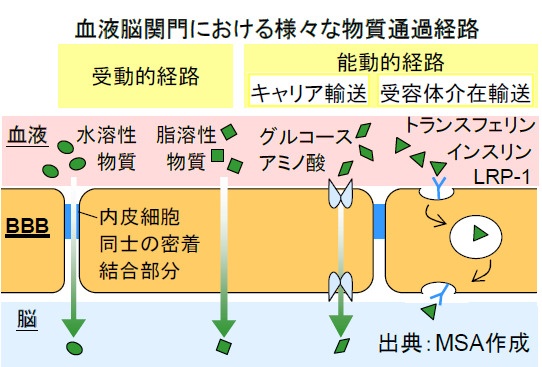
BBBは、物理的な障壁として機能する一方で、受容体やトランスポーターを介在して脳に必要な物質を取り込み、不要な物質を選択的に排出する「能動的」な輸送系機能を併せ持つ。例えば、脳のエネルギー源となるグルコースは、グルコーストランスポーター1(GLUT1)として知られる特殊な輸送タンパクを介してBBBを通過する。また、分子量が小さく油脂性の物質については、BBBは「受動的」にこれを透過させる。分子量が小さく水溶性でも脂溶性でもあるアルコールはその一例で、BBBを容易に通過して脳機能に影響を及ぼす。
現時点で、中枢神経系(CNS)全体に対して常に薬剤を送達できる確立された薬剤送達システム(DDS)はない。脳への薬剤送達では、受動拡散によってBBBを透過できるよう、低分子化合物の物性(大きさ、分子量、脂溶性など)を調整するアプローチが最も有効とされている。ただし、この方法では化合物の送達先に選択性を持たせることができず、末梢組織に幅広く分布することが防げない。
BBBの受動拡散メカニズムを利用するアプローチのほかにも、脳内に留置した細径のカテーテルから薬剤を拡散させる対流強化輸送法(Convection-EnhancedDelivery、以下CED)や、薬剤の経鼻投与によりBBBを回避するという方法もある。CEDには侵襲性の高い手術が必要となる。対照的に経鼻投与は、薬剤を鼻腔内にスプレーするなどし、神経上皮から脳内に薬物を届ける非侵襲的アプローチだが、静脈投与や経口投与と比べて1回に適用できる投与量が少ないことに加え、バイオアベイラビリティの変動が大きいため血中濃度の厳密な制御が難しいという課題が存在する。英国のナノメリクス(Nanomerics)は、マイクロパウダー技術と独自のデバイスを組み合わせた嗅神経経由のDDSを開発している。
最近では血管内の気泡(マイクロバブル)と超音波の併用により、一時的なBBBオープニングを促すDDSの開発も進んでいる。マイクロバブルに超音波を当てると、バブルが圧壊して血管内の薬物が血管外の細胞や組織へ漏れ出すことが分かっており、この仕組みをBBB突破に利用しようとするものだ。ただし、これには特殊な超音波照射装置を必要とし、医療機関での利用が前提となる。
BBBを突破する理想的なDDSは、侵襲性が低く、特別な医療機器を必要とせず、活性薬剤本体に修飾を加える必要もないものと考えられる。これらの要件を満たすと期待されるのが、BBBの能動的輸送メカニズムを利用するアプローチだ。BBBに発現し、BBB通過能を持つ受容体を利用し、トランスサイトーシス(経細胞輸送)として知られるメカニズムを介して薬剤を脳内に送達する。主な標的としては、トランスフェリン受容体、インスリン受容体、低比重リポタンパク質(LRP-1)受容体などがある。
BBBの能動的メカニズムを利用
現在、多くの企業がBBBの能動的輸送メカニズムを利用したDDS技術の開発に取り組んでいる。カナダのモントリオールを拠点とするアンジオケム(Angiochem)は、同社がアンジオペプ(Angiopep)と呼ぶ、LRP-1受容体を標的とした8~34のアミノ酸残基を持つペプチドのライブラリを構築している。同社はアンジオペプを基に、LRP-1受容体に結合し、さまざまな薬効を発揮するようデザインされた複数の新規ペプチド薬物複合体(PDC)候補を前臨床から臨床開発段階に有する。
カリフォルニア州サンディエゴ拠点のアルマジェン(ArmaGen)は、トランスフェリン受容体、インスリン受容体、LRP-1受容体などに結合する抗体フラグメントに治療用薬剤を融合させる技術を開発した。この技術を用いて、組み換えタンパクやモノクローナル抗体、低分子二本鎖RNA(siRNA)などを融合させることが可能だという。アルマジェンは、ハンター症候群やハーラー症候群などのライソゾーム蓄積症を適応症としたBBB通過薬の開発に取り組んでいる。
コネチカット州ギルフォード拠点のバイオエーシス(Bioasis)は、パテント取得済みのxB3プラットフォーム技術を持つ。xB3は血中にわずかな量が循環する天然の運搬体タンパクを基盤としたリガンドで、これをリンカー技術や遺伝子融合によって抗体や酵素、siRNAなどと結合させ、トランスサイトーシスによってBBBを通過させる。バイオエーシスもライソゾーム蓄積症の治療薬開発を目指している。
日本の企業もこの分野でしのぎを削っている。兵庫県に本社を置くJCRファーマは、静脈投与した薬剤を、トランスフェリン受容体を介してBBBを通過させる独自技術を持つ。東京大学発のベンチャー企業で特殊環状ペプチドの同定と最適化に特化するペプチドリームと2016年2月、BBB通過性キャリアペプチドの創製で共同研究契約を締結し、2019年5月、BBB通過性キャリアとして利用可能な特殊環状ペプチドの創製成功を共同で報告した。JCRファーマは2020年4月には、前述のアルマジェンを買収して子会社化している。
ペプチドリームは2019年1月、BBBを通過する新規PDCの開発を目的に塩野義製薬と、また2020年12月には神経筋疾患を対象とするPDCの共同開発で武田薬品工業(以下、武田)と契約した。塩野義との提携では、トランスフェリン受容体以外のBBB通過性に関わる複数の標的分子に対してキャリアペプチドを探索するほか、塩野義の医薬品または医薬品候補を結合させた新規PDC医薬品の創製を目指している。武田とは、ペプチドリームとJCRファーマが開発したトランスフェリン受容体結合ペプチドに武田の医薬品候補を組み合わせたPDC医薬品の共同研究を行う。両社は2021年7月に提携拡大を発表し、現在は神経変性疾患を対象としたPDCの共同開発も手掛けている。
ブレイゾン・セラピューティクス(以下、ブレイゾン)は、東京大学の片岡一則教授と東京医科歯科大学の横田隆徳教授の共同研究成果である、高分子ミセル(ミセル化ナノ粒子)を活用した脳内薬物送達技術を医療・ライフサイエンス領域で応用・実用化するために設立されたスタートアップ企業で、研究開発拠点としてマサチューセッツ州ケンブリッジに子会社を構える。ブレイゾンの高分子ミセル基盤のDDS プラットフォームであるブレイン・アクセス(Brain Access)は、GLUT1やトランスフェリン受容体を介したトランスサイトーシスを利用し、脳内への薬剤の効率的な送達を実現する。ナノ粒子に封入可能な薬剤は低分子に限らず、抗体や核酸医薬にも応用可能だ。
CNS領域のアンメットニーズに対応するBBB通過薬市場は今後、飛躍的に拡大する可能性がある。市場調査企業のグランド・ビュー・リサーチ(Grand View Research)の2019年のデータによると、アルツハイマー型認知症やパーキンソン病といった神経疾患と脳腫瘍分野の研究開発の進展を背景に、世界のBBB通過薬市場は2018年の推定5億8,200万ドルから2026年には46億ドル規模に拡大する見通しだ。
インタビュー
脳疾患治療薬分野におけるインテルを目指す
ブレイゾン・セラピューティクス、取締役会長 戸須 眞理子博士
2015年設立の創薬ベンチャーで東京大学のアントレプレナーラボに入居するブレイゾン・セラピューティクス(以下、ブレイゾン)は、血液脳関門(BBB)を突破する独自の薬物送達システム(DDS)プラットフォームであるブレイン・アクセス(BrainA c c e s s ) により、脳中枢神経系(CNS)疾患分野のアンメット・ニーズに対処しようとしている。同社の取締役会長の戸須眞理子博士に、ブレイゾンの技術や提携戦略について伺った。
———ブレイゾン設立の背景をお聞かせください。
戸須 ブレイゾンの技術の礎である高分子ナノミセル(ミセル化ナノ粒子)を利用したDDSの開発は、科学技術振興機構(JST)のセンター・オブ・イノベーション(COI)プログラムに選出された大規模な研究プロジェクトの1つとして走り出したものです。その研究成果を社会実装化するため、ベンチャー・キャピタル(VC)が発起人となって2015年10月にブレイゾンが設立されました。
私は2017年に社長として加わり、研究者を集めて自社内に研究開発(R&D)部門を構築し、また本格的な事業展開に向けて資金調達に乗り出しました。
———ブレイン・アクセスの作用機序をご説明ください。グルコースに覆われたナノ粒子に封入可能な薬剤は低分子に限られますか?
戸須 脳に必要なものを届けるためのBBBの能動的輸送メカニズムを利用した薬剤送達は、世界でもいくつかの企業が取り組んでいます。ブレイゾンは当初、脳にブドウ糖を運ぶグルコーストランスポーター1(GLUT1)にフォーカスしました。薬剤を封入した約50nmのナノ粒子(ミセル)をグルコースで覆うことで、GLUT1による取り込みが可能となります。この方法は、より高い脳内濃度に到達するために、食事制限などによる血糖コントロールの実施を前提としています。一方で、よりシンプルなBBB通過に向けて自社で検討を行った結果、現在はトランスフェリン受容体(Tf-R)を介したメカニズムによってナノ粒子を送達する技術の開発によりフォーカスしています。トランスフェリン受容体は実績のある経路で、日本ではJCRファーマもこの経路で送達しています。ブレイゾンはGLUT1 あるいはトランスフェリン受容体のどちらの経路においても、私たちの特徴であるミセルを利用します。ミセルには、低分子はもちろんのこと、核酸医薬やそのほかの生物学的製剤を封入することが可能です。現在最も注力しているのは、アンチセンスオリゴヌクレオチド(ASO)の送達です。ミセルは、ポリマーが自己会合したものです。このポリマーを、創薬モダリティに合わせてデザインすることになります。
———ポリマーのデザインはテイラーメイドですか?
戸須 低分子の場合は、1つ1つの構造が全く異なるためにテイラーメイドとなります。一方、ASOや抗体の場合は、個々の薬剤に大きな構造的差異がないため、それぞれ同様な構造のポリマーを利用できると考えています。
———ブレイン・アクセスのパテントの出願と取得状況をお聞かせください。
戸須 GLUT1を介した送達技術については、東京大学と東京医科大学が出願し、日本、米国、中国で成立したパテントの独占的ライセンスを保有しています。高分子ミセルについても、1件のパテントを保有していますが、さらなる開発を続けて、ポリマー設計、リガンドを含めて新規出願を予定しており、強固なパテントポートフォリオを構築する考えです。
———マサチューセッツ州ケンブリッジの子会社の役割を教えてください。
戸須 米国子会社はR&D拠点として機能しています。ケンブリッジには、共同研究を実施するボストンの提携先から紹介を受けて入居したラボ・セントラル(LabCentral)と呼ばれる非営利のシェア型研究施設にR&D機能を置いています。ケンブリッジは優れた人材を集めるなどのエコシステム的に素晴らしい場所です。
———2021年7月には日本のベンチャーキャピタル2社から総額約3億円を調達されました。この資金をどのように活用されるご予定ですか?
戸須 これは、追加投資という形で既存の投資家から調達しました。この資金調達の背景として、GLUT1からトランスフェリン受容体経路へのシフトがあります。向こう1年間でトランスフェリン受容体経路における十分なデータを蓄積し、そこから、新たに資金を調達する考えです。日本だけでなく、海外の投資家へのリーチも視野に入れています。
———御社の提携戦略をお聞かせください。
戸須 ブレイゾンは、脳に到達させたい薬剤を開発する製薬企業にDDSを提供する、プラットフォームビジネスを基盤としていますが、将来的には自社内でもパイプラインを構築する計
画です。また、2025年までにエグジットを目指しています。ブレイゾンは、CNS系疾患治療薬分野における“インテル(Intel)”(になること)を目指しています。世界中の製薬企業が開発した脳中枢神経系疾患の薬剤には、ベストインクラスのDDSとして必ずブレイゾンの技術が
入っているという将来を描いています。
