中枢神経系領域への挑戦
アンメット・メディカル・ニーズ
人口構成の高齢化とともに、神経変性疾患(アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症など)の増加が、大きな社会問題となっています(2017年G7に向けた学術会議共同声明)。また、小児から成人にかけての幅広い年齢層での原発性脳腫瘍は、侵襲性の高い外科手術や放射線療法に代替できる有効な化学治療薬が無く、有効な治療法が確立されていない医療上のニーズ(アンメット・メディカル・ニーズ)となっています。
脳内バリア
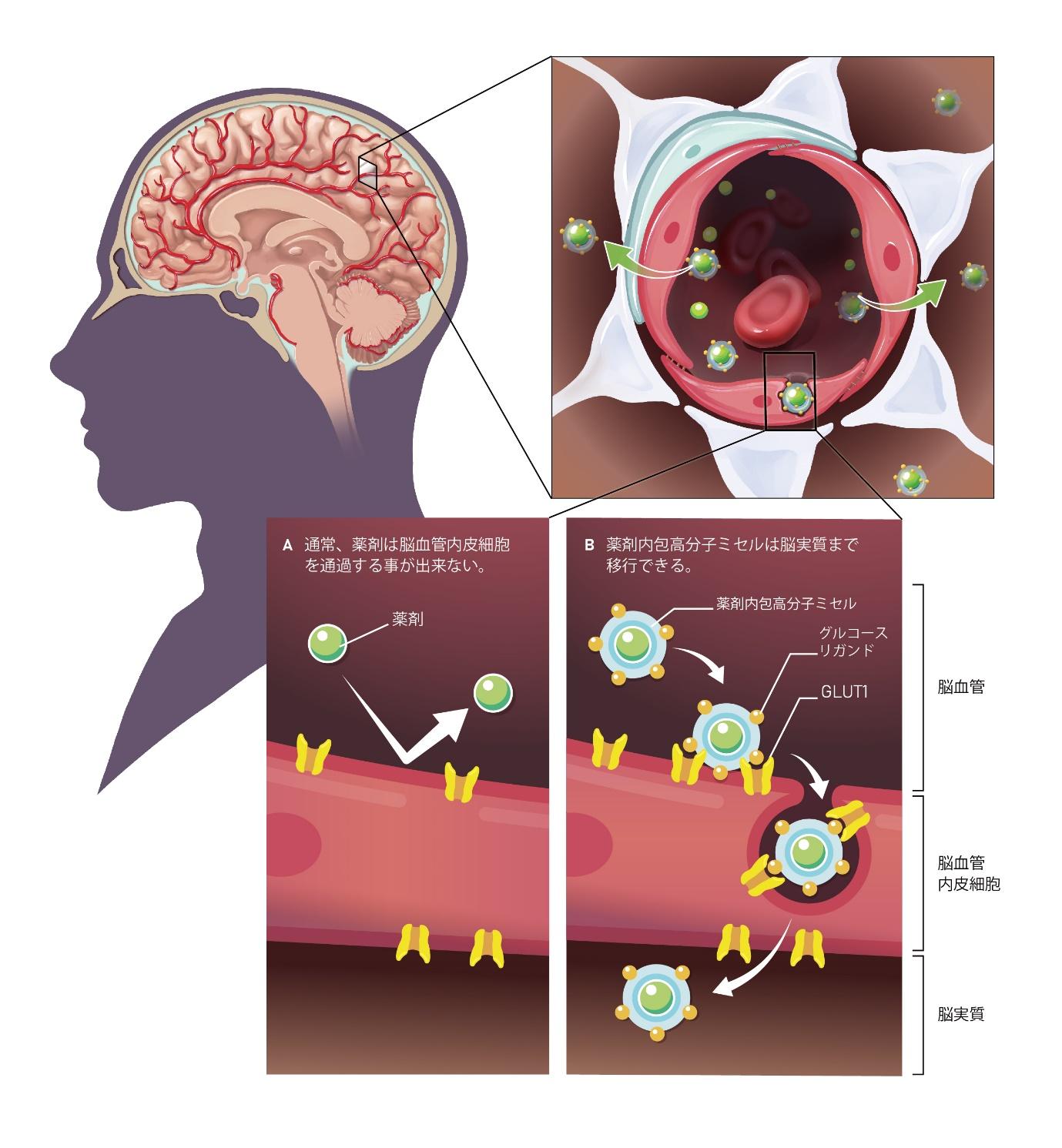
脳には血液脳関門 (Blood-brain barrier, BBB)と血液脳脊髄液関門(Blood-cerebrospinal fluid barrier, BCSFB)が存在し、循環血液と脳内の物質の輸送を厳密に制御しています。BBBは脳毛細血管内皮細胞であり、BCSFBは脳室にある脈絡叢上皮細胞がその実体ですが、いずれも細胞同士が密着結合で連結しているため、細胞間隙を介した物質の透過性はほとんどありません。さらに、BBBでは、細胞内あるいは細胞膜に溶けた薬物を、P-糖タンパク(MDR1, P-gp)と呼ぶ輸送担体が、血液側の細胞外に排出しています。これらの防御機構により、ほとんどの低分子薬物や核酸医薬を含む高分子薬剤は、BBBを通過することができず、神経変性疾患や原発性脳腫瘍への効果的な治療薬の開発が遅れている大きな原因となっています。
脳への薬剤送達効率
異物に対する防御機構とは逆に、脳の機能に必要であるグルコースやアミノ酸を脳内に輸送する担体(GLUT1やLAT1)や、トランスフェリンやインスリンに対する受容体が、BBB上に発現していることが知られています。これらの受容体に対するモノクローナル抗体を薬剤に融合させ、受容体の経細胞輸送(トランスサイトーシス)を利用してBBBを透過させる薬物デリバリーシステムが開発されていますが、輸送効率が高くない(1%程度)問題があります。
当社の技術、チャレンジ
株式会社ブレイゾン・セラピューティクスが保有するリガンド(ナビゲーション分子)に修飾された高分子ミセルに薬剤を内包してBBBを突破させる革新的薬剤送達技術は、1つの方法としては、食事制限により血糖値を低下させた後のグルコース負荷によるグルコース・トランスポーター(GLUT1)の血液脳関門血管側への局在を介したトランス・サイトーシスを利用しています。
また、もう1つの方法としてはトランスフェリンレセプター経由での血液脳関門での血管側への局在を介したトランスサイトーシスを利用しています。前者においては、GLUT1の脳毛細血管内皮細胞での発現量が、他のトランスポーター/レセプターに比べてはるかに高いため,輸送効率は、6% に達しています。後者においては、食事制限により血糖値を低下させることなく(コントロールなく)、高い送達効率を達成しています。
また、この技術では、内包される薬剤が代わっても、ポリエチレングリコールとポリアミノ酸の共重合体からなる同じ骨格を利用するため、最小限の変更で、低分子から抗体までの様々な薬剤様式(Modality)に適用することができる汎用性をもっています。
脳疾患に苦しむ患者さんに、いち早く有効な薬剤を届けるために、株式会社ブレイゾン・セラピューティクスは、日々、臨床開発に向けた研究を続けています。
イラスト著作者および協力:株式会社VESPERSTUDIO
よく見られる疾患
世界の人口のおおよそ2,100万人が統合失調症、3億人がうつ病、また、14億人が慢性疼痛で苦しんでいます(世界保健機関のファクトシート、および国際疼痛学会より)。これらの疾患に対する治療法はありますが、副作用、依存性や低い効果などに妥協せざるを得ません。これら特定の疾患を持つ患者さんに対して、私たちブレイゾンは、日々、治療法の改善に取り組んでいます。さらに、世界中には、6,300万人の神経変性疾患の患者さんが、治療法が無いか、あっても、貧弱なオプションしかないために苦しんでいます。
アルツハイマー認知症を発症するリスクは、年齢とともに上昇します。85歳までには、発症の可能性は40%に達します。世界の人口構成の高齢化のもとでは、神経変性疾患への予防及び治療が必要となる患者さんの数は、この20年で、2倍となり、1億5,000万人に達することが予想されています。健康であった日々や経験を取り戻し、新しい思い出を作るために、ブレイゾンの持つ新たなアプローチがどのように貢献できるかを、今こそ、共有していきましょう。
希少疾患
人間の脳は、私たちの体の内外から生じる要因によって制御される極めて複雑で多様性に富んだ細胞のネットワークから成り立っています。したがって、ごくわずかな遺伝子レベルの変異によって引き起こされる様々な希少疾患が、世界でもわずかな数の人に起こることの要因を解明することは困難です。CNSの希少疾患に対する新薬の開発費は高額となり、困難であるため、しばしば治療方法が制限されているか、または全く無い状況です。
中枢神経系の希少疾患に苦しむ患者様は、治療薬の開発が、患者様の日々の生活の質に与える大きな影響にも関わらず、しばしば、従来の新薬開発の対象からは、選択肢が無い状態で取り残されています。しかし、希少疾患を診断する手段がかつてないほどに容易になってきています。患者数が少ない希少疾患に対するデータサイエンスに基づく、Small Clinical Trialの活用、遠隔医療や患者団体 を通しての治験組み入れ患者数の増加、そして、医療サービスを十分に受けていない患者さんを助けることへの熱意などが、新しい治療法の開発に繋がっています。ブレイゾンでは、この活動に、強固な協力体制と強力な基盤技術をもって参加することで、患者数にかかわらず、患者様の生活の質の向上に貢献します。
治療への新たな道
中枢神経系疾患における多くのアンメットメディカルニーズに取り組むために、この挑戦の大きさと複雑性を深く認識することは重要です。人体の他の組織に比較して、疾患を理解し診断するために、中枢神経系の組織サンプルを採取することは、重要な機能にダメージを与えるリスクをもたらします。さらに、中枢神経系は非常に複雑なので、治療の可能性をテストしようと疾患モデルの作成を試みても、その実現は困難を極めます。 これらの要因は、安全かつ効果的でなければならない治療薬候補の選択過程において、普通では見られないような高い失敗確率を生じさせています。最終的に、候補薬物は疾患を修飾する標的分子の存在する場所に到達しなければなりません。中枢神経系の研究開発において、この最終ステップは、防御的な血液脳関門の存在によって、さらなる大きなハードルとなっています。 通常、投与された薬物は血液から組織へ移行しますが、脳内へは血液脳関門によって、薬物の移行が著しく制限されています。
ブレイゾン・セラピューティクスのプラットフォーム技術「Brain Access®」は、これらのアンメットメディカルニーズに対して、新しい治療方法への入り口を用意し、従来の低分子化合物や最新の生物学的薬剤のために中枢神経系への道を開くことによって、この最終的なハードルを克服していきます。

イラスト著作者および協力:株式会社VESPERSTUDIO
